Ⅰ 鉄代謝に関する総論(4)
細胞内における鉄代謝の調節機構
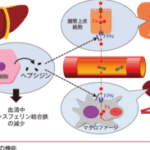
鉄代謝の調節には,ヘプシジンを中心とした全身レベルでの各臓器間の調節機構が存在するだけではなく,各細胞レベルにおいても独自の調節機構が存在する。
こうした個々の細胞の鉄代謝の恒常性は細胞内鉄濃度によって調節されている。最も有名な例は細胞内のフェリチンおよび TfR1 の翻訳(転写後)レベルでの発現調節である。
この調節を担うのが,鉄反応エレメント(iron responsive element: IRE)と鉄調節蛋白質(iron regulatory protein: IRP)と呼ばれるものである。
IRE とは, フェリチンや TfR1 の mRNA の非翻訳領域に存在する stem-loop構造であり,そこに結合する蛋白が IRP であり, IRP1 および IRP2 の 2 種類がある。IRP1 は中心部に鉄 – 硫黄クラスター(iron sulfur cluster: ISC)構造を有する。
この ISC は,[4Fe-4S] で表される立方体状の構造である(図Ⅰ-5)。
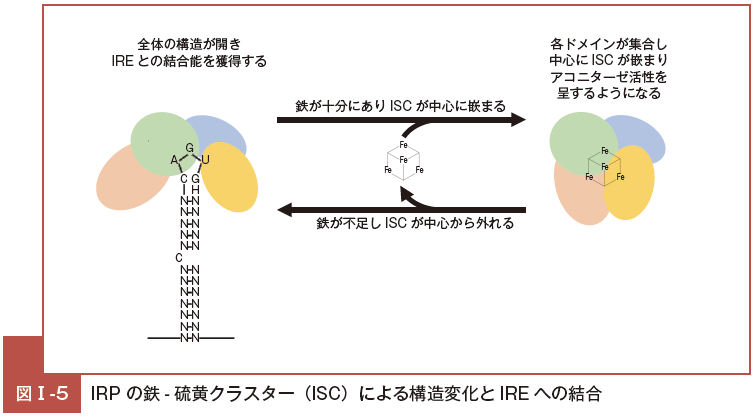
細胞内の鉄が十分で ISC が中心に嵌まり込んでいると,IRP は ISC を取り囲むような形態となり,この状態では TCA 回路のアコニターゼとしての酵素活性を有するが,その一方で,IRE 配列との結合ができなくなる。
逆に細胞内の鉄が不足して ISC がなくなった状態になると,IRP は中央に窪みを持つように広がる構造変化を起こして,IRE への結合力が出てくるが,アコニターゼとしての活性を失う24)。
IRP2 は特異的なアミノ酸配列である iron-dependent degradation(IDD)ドメインを持ち,IDD ドメインにヘムが結合した後に,ユビキチンリガーゼ(heme-oxidized IRP2 ubiquitin-ligase-1: HOIL-1)によりユビキチン化され分解される24)。
このほか,細胞内鉄濃度が高ま ると,F-box and leucine-rich repeat protein 5(FBXL5)の iron-sensing hemerythrin 様ドメインに鉄が結合することで,FBXL5 は安定化する25)。
その結果,FBXL5 が IRP2 のみならず IRP1 に結合し,IRP はユビキチン化され分解される26)。このように,IRE と IRP の結合状態は,IRP の構造変化あるいは分解により変化する。
TfR1 とフェリチン mRNA における IRE-IRP システムについて見ていく(図Ⅰ-6)。
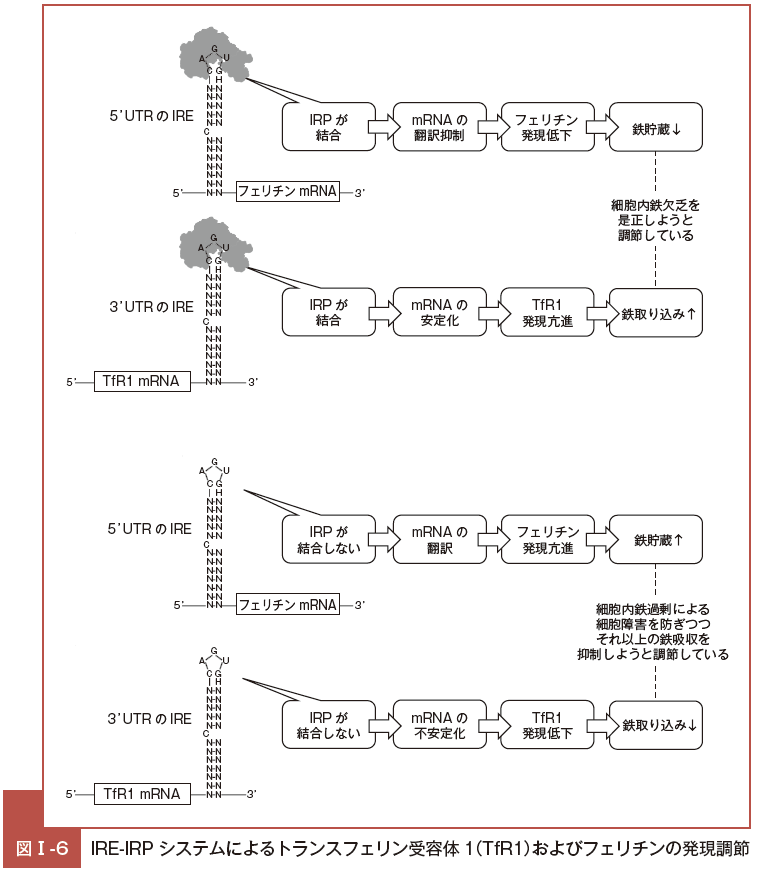
IRP がフェリチン mRNA の 5’ 側に存在する IRE に結合すると翻訳が阻害される一方,TfR1 mRNA の 3’ 側に存在する IRE に結合すると mRNA の ribonuclease による分解が阻害され mRNA が安定化し翻訳が促進する。
つまり,細胞内鉄濃度の低下によりフェリチン合成は低下し TfR1 合成は亢進する。これらの発現変化は,TfR1 を介した細胞内への鉄の取り込みを亢進させ,なおかつフェリチンへの格納を減少させるため,細胞内鉄濃度を上昇させる方向となり,崩れかけた細胞内鉄濃度を一定に保つことにつながる。鉄濃度の上昇の際には,これと逆の現象が生じる。
これらの遺伝子のほかにも,DMT-1,FPN などの mRNA にも IRE 構造が存在し,それらの発現調節に関与している27)28)。