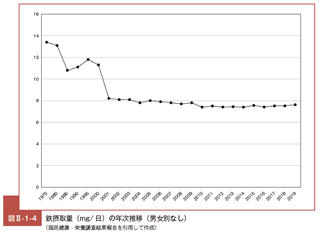
Ⅰ 鉄代謝に関する総論(3)
体内の鉄代謝は,このように複数の臓器が関与して全体の量や分布が,ある一定の範囲内に保たれているが,こうした鉄の恒常性を保つには,物理的に離れた場所に存在する臓器間を協調させる機構が必要となる10)。
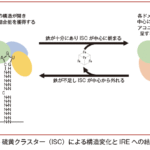
この調節を行う分子がヘプシジンである。
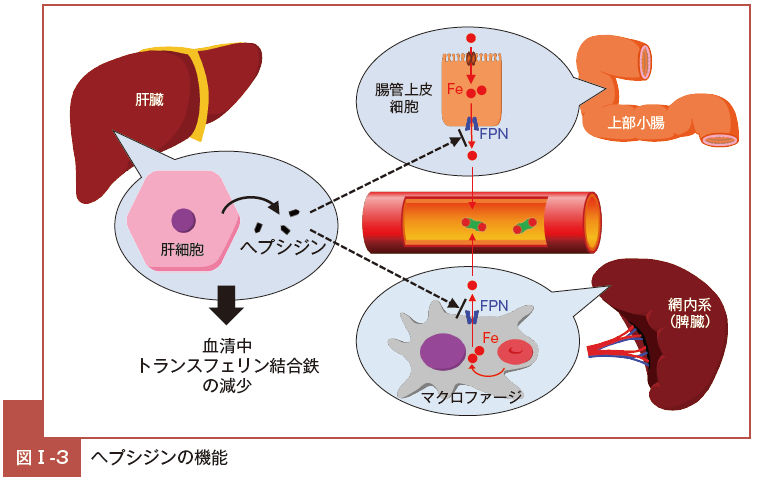
ヘプシジンは鉄過剰時に肝臓からの発現が亢進し血中濃度が増加し,消化管上皮細胞およびマクロファージの細胞膜表面のFPN の中心腔内に結合し,鉄の輸出を阻害するのみならず11),その分解を促進し,FPN 発現を減らすように機能する10)。
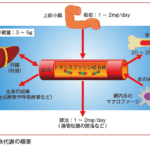
鉄過剰状態になると生体はヘプシジン発現を亢進させ,最終的に消化管での鉄吸収を抑制し,また,網内系を介した鉄の再利用も抑制し,鉄過剰を是正する方向に機能するのである(図Ⅰ-3)。
この鉄代謝調節因子ヘプシジンの発現調節には,非常に多くの経路・分子の関与が明らかになっている(図Ⅰ-4)。
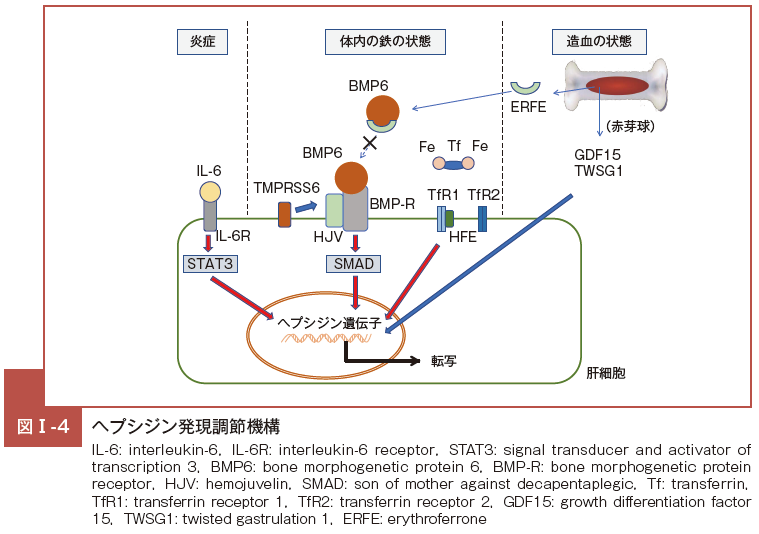
中心的役割を占めると考えられているのが,bone morphogenetic protein(BMP)とその受容体 BMP recepto(rBMP-R),若年性遺伝性へdyserythropoietic anemia: CDA) などで ERFE 産クロマトーシス責任分子 hemojuvelin(HJV),それらから細胞内へ伝わる SMAD などを介したシグナル伝達経路である12)。
これに加え,遺伝性へモクロマトーシス責任分子群トランスフェリン受容体(transferrin receptor: TfR)2 やHFE を介した経路,遺伝性鉄剤不応性鉄欠乏性貧血で変異が認められる TMPRSS6(Matriptase-2)などの関与が明らかになってきている13)。
これらは生体内の鉄の状態変化を感知してヘプシジン発現調節を行っていると考えられているが,その機構の詳細の全てが解明されている訳ではない。
鉄の状態とは別に,炎症性サイトカイン interleukin-6(IL-6)から JAK-STAT3 系を介してヘプシジンの発現が調節される経路も存在する14)。
さらに近年,サラセミアを中心としてヘプシジン発現を調節する新規の液性因子の報告も相次いでいる。
サラセミアでは骨髄中の赤血球系前駆細胞は増加しているがアポトーシスに陥る状態が持続しており,そこからヘプシジンを抑制する因子として growth differentiation factor 1(5 GDF15)やtwisted gastrulation (1 TWSG1)が分泌されていることが報告されている15)16)。
これらはヘプシジン分泌を不適切に低下させてしまい,鉄過剰状態であるにもかかわらず消化管での鉄吸収が持続することにつながる。
サラセミアのみならず,輸血非依存性の環状鉄芽球を伴う骨髄異形成症候群(myelodysplastic syndromes: MDS) においても,GDF15 産生亢進によりヘプシジン産生が抑制されることが示唆されている。
これらに加え,近年,さらに新たな調節因子としてエリスロフェロン(erythroferrone: ERFE) が報告された17)。ERFEは BMP2/6 と結合し,BMP-R-SMAD 経路を抑制することによって,ヘプシジン産生を抑制する18)。
正常造血では,エリスロポエチン(EPO)依存性に赤芽球の ERFE 産生が調節されて,造血に必要な鉄が赤芽球に供給される。
また,出血や溶血などで貧血に陥ると,低酸素により腎臓からの EPO 産生が高まり,赤芽球からの ERFE 産生が増加し,消化管からの鉄吸収や網内系からの鉄放出が亢進して,造血に必要な鉄が供給される19)。
その他,骨髄内の無効造血と赤芽球過形成がみられるサラセミア,先天性赤血球生成異常性貧 血(congenitaldyserythropoietic anemia: CDA)などでERFE 産生が亢進することや20)21),SF3B1 変異を伴う MDSにおいてはスプライシング異常に伴うアミノ酸置換の結果,活性の高い ERFE の産生が亢進し22),その結果,消化管からの鉄吸収が亢進して鉄過剰を呈することが知られている。
古くから,体内鉄貯蔵状態を反映して鉄代謝を調節するstorage regulator と,造血状態を反映して鉄代謝を調節する erythroid regulator が存在すると考えられてきたが,ヘプシジンを前者とすると,ERFEなどは後者であると考えられ,今後の更なる研究の進展が注目される。
このように,非常に様々な経路が複雑に絡み合い,ヘプシジン発現は調節されている23)。