Ⅰ 鉄代謝に関する総論(2)
過剰鉄による細胞毒性
鉄過剰状態では,細胞内鉄量が増加するほかに,流血中の Tf に結合していない鉄である Non-Tf- bound iron(NTBI)が増加する3)4)。
NTBI は細胞表面の金属輸送体であるZRT/IRT-like protein(ZIP)8, ZIP14,divalent metal transporter 1(DMT-1)などにより,直接的に細胞質内に取り込まれ5)-7),LIPの鉄を増加させる。
これら蛋白質に結合していない遊離鉄が増加すると, 電子供与体として働き, Fenton 反応や Haber-Weiss 反応を経て,ROS のなかで毒性の強いヒドロキシラジカル(・OH)を生成する。・OH は炭水化物,蛋白質および核酸(DNA)を 標 的 とし て 細 胞 を 傷 害 する8)。
このほか, malondialdehyd(e MDA)および4-Hydroxy-2-nonenal(4-HNE)といった過酸化脂質が誘導されると,これらの脂質由来の ROS は,長い半減期を持つため,慢性的な細胞毒性を発揮し臓器障害を惹起する。
生体内鉄代謝制御の概要
上述のごとく,鉄は生体のホメオスターシスの維持に必須であるが,鉄過剰状態では毒性を発揮する。
そのため体内における鉄の量は常にある一定の範囲内になるよう調節される必要がある。こうした鉄代謝の調節機構を理解するためには,まず生体内の鉄代謝の概要を理解する必要がある。
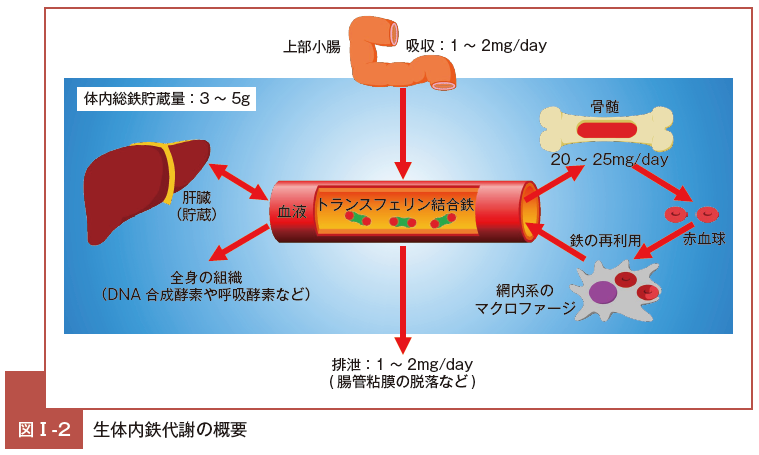
鉄は栄養元素の一つであり,食事に含まれる鉄は上部小腸から吸収される。食事中の鉄は,ヘム鉄もしくは非ヘム鉄として含まれているが,どちらも腸管上皮細胞を通り血液中に入ることで鉄の吸収が成立する。
主に3価で含まれる非ヘム鉄は腸管上皮細胞膜上の duodenal cytochrome b(Dcytb)の働きによってまず2価に還元され,DMT-1 によって細胞内に取り込まれている。
一方のヘム鉄は,ヘムの形態のまま取り込まれると考えられており,吸収効率は非ヘム鉄に比較して高いが,未だその吸収の分子機構には不明な点が多い。
いずれの形態の鉄も,腸管上皮細胞内に取り込まれた後に,血管内腔側に発現しているフェロポーチン(ferroportin: FPN)によって血管内へ放出される。
血液中に入った鉄は,hephaestin の働きにより3価に酸化され,Tf に結合し,全身へ運搬される。
一部の鉄は肝臓での貯蔵や全身の細胞の呼吸酵素・ DNA 合成酵素などへの利用に回されるが,6 〜 7割程度の鉄は骨髄における赤血球造血での構成要素として使用される。
産生された赤血球は,Hb の働きにより全身への酸素の運搬・供給を担うが,120日程度の生理的寿命があり,常に一定数の赤血球が壊れ,新しい赤血球に置き換わっている。
寿命を迎えた赤血球の破壊は主に脾臓で行われる。脾臓では網内系マクロファージが赤血球の破壊を担当している。
マクロファージは老廃赤血球を捕捉して破壊するが,その過程でHb から鉄を得ることができる。マクロファージはこの鉄を体外に捨てず,腸管上皮細胞と同様にFPN を介して再び血管内へ戻している。
血液中に再び戻った鉄は,まだ鉄と結合していない T(f apo-Tf)と結合し,再び全身を循環する。このように,Hb 構成要素として赤血球に含まれた鉄は,網内系を介して再利用に回されるのである9)。
一方,鉄の体外への排出は極めて特徴的である。生体は鉄を積極的・能動的に体外へ排出する機構を備えていない。
日々剥がれ落ちていく消化管上皮細胞に含まれる鉄や,尿や汗に微量に含まれる鉄など非常に微量の鉄しか排泄されていない。
ごくわずかにしか鉄の排出がないため,通常の状態ではそれに見合う分しか鉄の吸収も行われていないことがわかっている。
赤血球造血を中心とした鉄の利用をまかなっているのは,新規に体内へ吸収された鉄が主体ではなく,体内に既に存在している鉄を再利用しているものが大部分を占めている。
このことから,鉄代謝は半閉鎖的回路を構築していると言え,非常に大きな特徴となっている(図Ⅰ-2)。