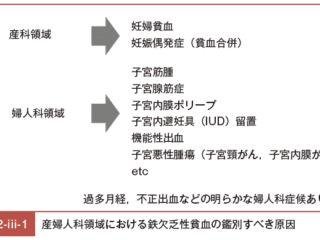
鉄剤不応性鉄欠乏性貧血の遺伝的素因
鉄欠乏性貧血の中に,経口鉄剤投与に反応せず,先天性にTMPRSS6 遺伝子異常で起こる症例が 2008 年に報告された21)。
この TMPRSS6 は,肝臓に特異的に発現する膜型セリンプロテアーゼ 2 であり, TMPRSS6 遺伝子変異は,bone morphogenetic protein(BMP)の一つである BMP-6 シグナルによるヘプシジン産生に抑制がかからず,ヘプシジンを不適切に増加させてしまう。
この増加したヘプシジンにより,十二指腸からの鉄の吸収阻害と網内系からの鉄の放出抑制が起こる。
そのため,血液中では血清鉄は低値となり,赤血球造血に対しては鉄欠乏となるため小球性貧血となるが,網内系には鉄があるため血清フェリチン値は正常もしくは高値を呈する。
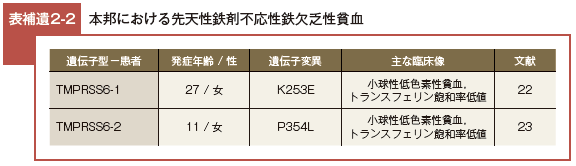
本邦における TMPRSS6 遺伝子の変異 は, c.757A>G(p.K253E)22)と c.1175C>T(p.P354L)23)の2 例が報告されている。
どちらの症例も経口鉄剤では貧血が回復しなかったが,鉄剤を静注することにより貧血は回復した。
この P354L 変異については同じ領域にある Y355X の変異が IRIDA の原因との報告があるため貧血を引き起こしたと考えられる(表補遺2-2)。
IRIDA は常染色体劣性遺伝とされるが,片方の染色体に変異が存在することが鉄欠乏に寄与していると考えられる症例も一部あり,今後の症例集積が待たれるところである。
今後の方向性と血清ヘプシジン値測定の意義
旭川医科大学が中心となり行った平成 22 年度厚生労働科学研究補助金「ヘモクロマトーシスの実態調査と診断基準」の研究結果1)より,本邦における鉄過剰症は輸血後鉄過剰症がほとんどを占め,ごく一部が遺伝性であることが判明した。
しかし,その報告以降にも新たな遺伝子変異を持つ家系が次々と報告されており,その遺伝子変異の種類や頻度,実態に関して十分解明されたとは言い難い。
特に本邦においては,欧米とは異なり幅広い遺伝子変異が鉄過剰症に関与しているため,今後も症例の蓄積を続け,本邦における HH の特徴を明らかにし,治療の選択に科学的根拠を与えることが,重要な課題として残されている。
一方,本邦における IRIDA については,詳細な疫学調査がなされておらず,TMPRSS6 遺伝子変異による症例数は 2 例と極めて少ない。
これらの原因が特定されない鉄過剰症や鉄欠乏性貧血においては鑑別診断が重要であり,そのためには鉄代謝の調整因子である血清ヘプシジン値の測定が有用と考えられる(現時点では血清ヘプシジン検査は保険適用外であり株式会社エムシープロット・バイオテクノロジーによる受託研究で測定)。
ヘプシジンの発現は体内貯蔵鉄量に応じて変化するが,血清フェリチン値に比べてヘプシジン値が異常に低い場合,あるいは異常に高い場合には,ヘプシジン産生を制御している因子の異常が疑われ,遺伝子解析を行うきっかけとなる。
通常とは異なる臨床的特徴を持つ鉄過剰症や鉄欠乏性貧血の患者に遭遇した場合には,(現時点では臨床研究の扱いとなるが)血清ヘプシジン値測定が疾患のスクリーニングや病態の把握,治療のモニタリングに役立つものと考える。
文献
- Ikuta K, Hatayama M, Addo L, et al. Iron overload patients with unknown etiology from national survey in Int J Hematol. 2017; 105: 353-360.
- Feder JN, Gnirke A, Thomas W, et al. A novel MHC class I-like gene is mutated in patients with hereditary haemochromatosis. Nat Genet. 1996; 13: 399-408.
- Sohda T, Okubo R, Kaminura S, et al. Hemochromatosis with HFE gene mutation in a Japanese patient. Am J Gastroenterol. 2001; 96: 2487-2488.
- Imanishi H, Liu W, Cheng J, et al. Idiopathic hemochromatosis with the mutation of Ala176Val heterozygous for HFE Intern Med. 2001; 40: 479-483.
- Takano A, Niimi H, Atarashi Y, et al. A novel Y231del mutation of HFE in hereditary haemochromatosis provides in vivo evidence that the Huh-7 is a human haemochromatotic cell line. Liver Int. 2011; 31: 1593-1597.
- Vecchi C, Montoshi G, Pietrangelo A. Huh-7: a human “hemochromatotic”cell line. Hepatology. 2010; 51: 654-659.
- Hayashi H, Wakusawa S, Motonishi S, et al. Genetic background of primary iron overload syndromes in Japan. Intern Med. 2006; 45: 1107-1111.
- Nagayoshi Y, Nakayama M, Suzuki S, et al. A Q312X mutation in the hemojuvelin gene is associated with cardiomyopathy due to juvenile haemochromatosis. Eur J Heart Fail. 2008; 10: 1001-1006.
- Maeda T, Nakamaki T, Saito B, et al. Hemojuvelin hemochromatosis receiving iron chelation therapy with deferasirox: improvement of liver disease activity, cardiac and hematological function. Eur J Haematol. 2011; 87: 467-469.
- Kawaguchi T, Ikuta K, Tatsumi Y, et al. Identification of heterozygous p.Y150C and p.V274M mutations in the HJV gene in a Japanese patient with a mild phenotype of juvenile hemochromatosis: A case Hepatol Res. 2020; 50: 144-150.
- Takami A, Tatsumi Y, Sakai K, e t Juvenile Hemochromatosis: A Case Report and Review of the Literature. Pharmaceuticals. 2020; 13: 195.
- Hattori A, Tomosugi N, Tatsumi Y, et al. Identification of a novel mutation in the HAMP gene that causes non-detectable hepcidin molecules in a Japanese male patient with juvenile hemochromatosis. Blood Cells Mol Dis. 2012; 48: 179-182.
- 土田健一 , 種田紳二 , 三澤和史 , ほか . 糖尿病,下垂体性性腺機能低下症,肝線維化を呈した新規 TfR2 遺伝子変異による原発性ヘモクロマトーシス (HH Type 3) の 1 例 . 糖尿病 2010; 53: 247-252.
- Liu W, Shimomura S, Imanishi H, et al. Hemochromatosis with mutation of the ferroportin 1 (IREG1) gene. Intern Med. 2005; 44: 285-289.
- Honma Y, Karasuyama T, Kumamoto K, et al. Type 4B hereditary hemochromatosis due to heterozygous p.D157A mutation in SLC40A1 complicated with hypopituitarism. Med Mol Morphol. 2021; 54: 60-67.
- Le Gac G, Ka C, Joubrel R, et Structure-function analysis of the human ferroportin iron exporter (SLC40A1): effect of hemochromatosis type 4 disease mutations and identification of critical residues. Hum Mutat. 2013; 34: 1371-1380.
- 松岡直紀 , 林学 , 高橋裕太 , ほか . アルコール性肝障害を合併し遺伝子変異と異なる病態を呈した Ferroportin 病の 1 例 . 日本消化器病学会誌 2020; 117: 1100-1108.
- Yamakawa N, Oe K, Yukawa N, et al. A Novel Phenotype of a Hereditary Hemochromatosis Type 4 with Ferroportin-1 Mutation, Presenting with Juvenile Intern Med.amashita T, Morotomi N, Sohda T, et al. A male patient with ferroportin disease B and a female patient with iron overloadsimilar to ferroportin disease B. Clin J Gastroenterol. 2014; 7: 260-264.2016; 55: 2697-2701.
- Nishina S, Tomiyama Y, IkutaK, et al. Long-term phlebotomy successfully alleviated hepatic iron accumulation in a ferroportin disease patient with a mutation in SLC40A1: a case report. BMC Gastroenterol. 2021; 21: 111.
- Finberg KE, Heeney MM, Campagna DR, et al. Mutations in TMPRSS6 cause iron-refractory iron deficiency anemia (IRIDA). Nat Genet. 2008; 40: 569-571.
- Sato T, Iyama S, Murase K, et al. Novel missense mutation in the TMPRSS6 gene in a Japanese female with iron- refractory iron deficiency anemia. Int J Hematol. 2011; 94: 101-103.
- Kodama K, Noguchi A, Adachi H, et Novel mutation in the TMPRSS6 gene with iron-refractory iron deficiency anemia. Pediatr Int. 2014; 56: e41-e44.